|
INTRODUÇÃO
Esta experiência tem como objectivo observar a acção da amilase salivar sobre o
amido.
O amido é um polissacarídeo constituído por um grande número de monossacarídeos
(glicose) unidos por ligações glicosídicas (reacção entre dois grupos hidroxilo com libertação de
uma molécula de água). É insolúvel em água, não tem sabor doce e é desdobrado em maltose (e esta
em glicose)(figura 1) através de várias reacções químicas catalisadas por enzimas específicas: a
amilase salivar e pancreática.

Figura 1- Molécula de maltose.
A enzima que estudámos foi a amilase salivar ou ptialina a qual é segregada
pelas glândulas salivares.
As enzimas são proteínas compostas por aminoácidos e actuam como
biocatalisadores que regulam a velocidade de muitas reacções químicas envolvidas no metabolismo
celular.
A substância sobre a qual uma enzima actua chama-se substrato. Este ao ligar-se ao
centro activo da enzima é desdobrado formando-se duas substâncias, dando-se a esta reacção o nome
de catabolismo; ou então, liga-se a outro substrato formando um produto final, reacção anabólica
(figura 2).
Para que estas reacções se dêem é necessária energia à qual se dá o nome de
energia de activação.

Figura 2- Acção da enzima sobre o substrato.
Nesta experiência utilizaram-se seis tubos de ensaio para testar o meio óptimo
onde a enzima actua sobre o amido: utilizou-se HCl para se obter um meio ácido; utilizou-se gelo
para se obter um meio frio; ferveu-se saliva para simular as temperaturas altas.
Os testes da
água iodada e do licor de Fehling foram executados nesta experiência. A água iodada fica azul no
caso da solução conter amido; se não, fica incolor. O licor de Fehling, após aquecimento da
lamparina, fica com um precipitado cor de tijolo se contiver muitos açúcares redutores. A reacção
do licor de Fehling com os açúcares redutores está expressa na figura 3.

Figura 3- Reacção do licor de Fehling com os açúcares redutores e escala de
cores.
PROTOCOLO EXPERIMENTAL
MATERIAL
- saliva
- cozimento de amido a 1%
- soro fisiológico a 1%
- HCl
- pepsina
- água iodada
- 2 gobelés 40 ml
- seis tubos de ensaio
- suporte para tubos de ensaio
- pipetas graduadas
- pinça de madeira
- lamparina
- conta-gotas
- banho-maria
- gelo
- licor de Fehling
METODOLOGIA
- Prepare 6 tubos de ensaio e etiquete-os.
- Estimule a produção de saliva e recolha-a.
- Faça uma diluição de 1:1 em soro fisiológico.
- Coloque 1 ml de saliva diluída num tubo de ensaio e ferva. Depois deixe-o arrefecer.
- A cada tubo adicione 1 ml das substâncias indicadas, no quadro 1.
|
|
Tubos |
|
Substâncias a adicionar
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Amido
|
•
|
•
|
•
|
•
|
•
|
•
|
|
Saliva
|
•
|
•
|
|
|
•
|
|
|
HCl
|
|
•
|
|
|
|
|
|
Saliva fervida
|
|
|
•
|
|
|
|
|
Pepsina
|
|
|
|
|
|
•
|
Quadro 1- Conteúdo dos vários tubos.
Adicione a cada tubo, 3 gotas de água iodada.
Tape os tubos e agite-os. Coloque os tubos 1, 2, 3, 4 e 6 em banho-maria, a 37ºC e o tubo 5
em gelo.
Ao fim de 15 minutos remova os tubos do banho-maria e do gelo. Registe os resultados.
Faça o teste do licor de Fehling, nos 6 tubos.
Registe os resultados.
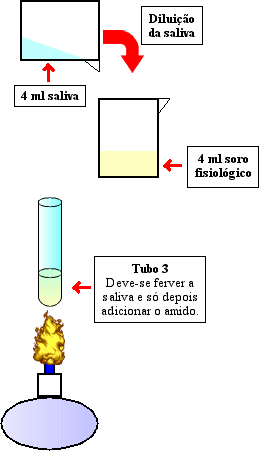
Figura 4- Algumas precauções para o sucesso da experiência.
RESULTADOS
Figura 5- Resultados finais obtidos nos tubos de ensaio.
|
|
|
Testes |
|
Tubos
|
Conteúdos
|
Cor inicial
(água iodada)
|
Cor ao fim
15 minutos
|
Cor final (Licor
de Fehling)
|
|
1
|
1 ml saliva +
1 ml amido
|
Incolor
|
Incolor
|
Precipitado cor
de tijolo
|
|
2
|
1 ml saliva + 1 ml
HCl + 1 ml amido
|
Incolor
|
Rosa
|
Amarelado
|
|
3
|
1 ml saliva fervida
+ 1 ml amido
|
Incolor
|
Incolor
|
Rosa velho
|
|
4
|
1 ml amido
|
Azul
|
Rosa
|
Violeta
|
|
5
|
1 ml saliva (no gelo)
+ 1 ml amido
|
Azul
|
Arroxeado
|
Precipitado cor
de tijolo
|
|
6
|
1 ml pepsina +
1 ml amido
|
Azul
|
Azul
|
Precipitado cor
de tijolo
|
Quadro 2- Quadro de resultados obtidos ao longo da experiência da digestão do
amido pela amilase salivar.
DISCUSSÃO
No tubo 1, contendo saliva e amido, efectuou-se o teste da água iodada e
observou-se que não continha amido pois estava incolor. Ao fim de 15 minutos em banho-maria a
37ºC a cor manteve-se, ou seja, não continha amido. Quando se fez o teste do licor de Fehling
formou-se um precipitado cor de tijolo o que indica a presença de açúcares redutores. Como o
amido é desdobrado em duas moléculas de maltose e estas são açúcares redutores, concluiu-se que
houve digestão do amido no tubo 1.
No tubo 2, contendo saliva, HCl e amido, efectuou-se o
teste da água iodada e observou-se que não continha amido pois estava incolor. No entanto, isto
não devia ter sucedido pois o tubo devia ter ficado azul devido à acção do HCl sobre a amilase
salivar, o qual quebra as ligações peptídicas da enzima. Ao fim de 15 minutos em banho-maria a
37ºC o tubo passou a rosa o que indica que a amilase desdobrou uma pequena parte do amido mas não
na totalidade devido ao HCl. Quando se fez o teste do licor de Fehling o tubo ficou amarelo o que
indica uma pequena quantidade de açúcares redutores. No entanto, o resultado não devia ter sido
este. Constatou-se então que se obteve este resultado devido a um erro de execução pois devia-se
ter colocado no tubo primeiro a saliva e o HCl para este neutralizar a enzima e só depois o
amido.
No tubo 3, contendo saliva fervida e amido, efectuou-se o teste da água iodada e
observou-se que não continha amido pois estava incolor. No entanto, isto não devia ter
acontecido. O tubo deviater ficado azul pois quando a saliva é fervida, devido às altas
temperaturas a amilase salivar fica desnaturada impedindo a enzima de actuar sobre o amido, não
havendo portanto o seu desdobramento, e mesmo que se volte a baixar a temperatura ela permanece
desnaturada. Ao fim de 15 minutos em banho-maria a 37ºC, o tubo manteve-se incolor quando devia
estar azul pelas razões atrás mencionadas. No teste do licor de Fehling obteve-se a cor rosa
velho indicando uma pequena quantidade de açúcares redutores, os quais não deviam existir.
Concluiu-se que a saliva não ferveu totalmente, ou seja, uma pequena parte das enzimas permaneceu
activa.
No tubo 4, contendo apenas amido, efectuou-se o teste da água iodada e, como se
esperava, obteve-se a cor azul que indicava que o amido não tinha sofrido alterações. Ao fim de
15 minutos em banho-maria a 37ºC, o tubo encontrava-se rosa, o que indicava que o amido não tinha
sofrido alterações significativas. No teste do licor de Fehling o tubo ficou violeta o que
indicava que não continha uma quantidade significativa de açúcares redutores1. Estes
resultados já se esperavam pois não havia quaisquer substâncias a actuar sobre o amido.
No
tubo 5, contendo saliva e amido e depois colocado no gelo, efectuou-se o teste da água iodada
obtendo-se a cor azul que indicava que contém amido. Ao fim de 15 minutos no gelo o tubo
continuava entre o azul e o roxo o que indicava que o amido continuava inalterado. Isto deve-se
às baixas temperaturas actuarem sobre a amilase tornando-a inactiva. No entanto, quando se fez o
teste do licor de Fehling observou-se um precipitado cor de tijolo que indicava que tinha
ocorrido a digestão do amido. Ela ocorreu devido ao tempo que é necessário para se fazer o teste
do licor de Fehling durante o qual a enzima torna-se activa devido à variação da temperatura,
começando imediatamente a actuar sobre o amido.
No tubo 6, contendo pepsina e amido,
efectuou-se o teste da água iodada e, como se esperava, obteve-se a cor azul que indica que o
amido não sofreu a acção da pepsina. Ao fim de 15 minutos em banho-maria a 37ºC a cor manteve-se,
o que indicava que o amido continuava inalterado. No entanto, quando se efectuou o teste do licor
de Fehling obteve-se um precipitado cor de tijolo que indicava que a solução continha açúcares
redutores. Concluiu-se então que a pepsina estava contaminada com açúcares redutores, uma vez que
não houve a digestão do amido. A razão pela qual este tubo foi incluído nesta experiência foi a
de observar se cada enzima é específica de um só substrato, ou seja, se a amilase salivar é a
única enzima capaz de actuar sobre o amido.
1 Pode-se ter formado uma pequena quantidade
de açúcares redutores devido à acção da chama da lamparina quebrando assim as ligações
glicosídicas do amido.
CONCLUSÃO
Com esta experiência, concluiu-se que a amilase salivar é uma enzima específica
do amido, que tem uma temperatura óptima de funcionamento nos 37ºC e tem um pH óptimo de
funcionamento igual a 7, isto é, neutro.
Concluiu-se também que a amilase fica inactiva com as
temperaturas baixas mas à medida que se vai aumentando a temperatura ela fica novamente activa.
No entanto quando se aumenta muito a temperatura a enzima fica desnaturada e mesmo que se volte a
descer a temperatura ela permanece desnaturada. Observou-se também, no tubo 5, que ela actua
muito rapidamente sobre o amido, desdobrando-o numa questão de minutos.
A amilase salivar é
destruída num meio ácido, como se observou no tubo 2.
No que respeita ao amido, concluiu-se
que este é desdobrado em maltose que é um açúcar redutor.
A acção da amilase salivar sobre o
amido observada nesta experiência pode ser traduzida por meio de uma reacção química
esquematizada na figura 6.

Figura 6- Reacção química da acção da amilase salivar sobre o amido.
AUTO-CRÍTICA
A experiência realizada foi de fácil execução e muito educativa. Cometeram-se
alguns erros na sua execução (talvez por distracção), o que prejudicou um pouco os resultados que
se esperavam.
No entanto, acho que a experiência estava incompleta porque faltou testar a
acção da amilase salivar num meio básico. Podia-se ter colocado num tubo 7, saliva juntamente com
NaOH adicionando depois o amido.
As pessoas responsáveis pelo laboratório de TLB (professores
de TLB ou CTV) deviam adquirir uma pepsina nova pois está claro que a que se utilizou está
contaminada com açúcares redutores. Por isso é de tomar nota a pepsina, num inventário de
reagentes que são necessários adquirir pela escola.
Aproveito também para agradecer à
professora de TLB que me deixou entregar este relatório mais tarde, devido a um problema que tive
com o computador onde o executava.
BIBLIOGRAFIA
Leite, Ana et al, Do microscópio à célula, Bloco 1, 1ª Edição,
Areal Editores, Porto, 1994.
Leite, Ana et al, Da célula ao organismo, Bloco 2, 1ª Edição,
Areal Editores, Porto, 1996.
Copyright 1996
Todos os direitos reservados
|











